동물실험에서 임상시험결과 도출 (From laboratory and animal studies to patients)
많은 연구자들이 궁금해합니다. 동물실험을 통해 미리 임상시험을 예측할 수 있을지 말입니다. 결론적으로 동물실험을 통해서 임상실험 결과를 직접적으로 예측할 수 없습니다. 간접적으로 "가능성 있겠는데?"정도입니다. 많은 연구자들도 궁금했던 것 같습니다. 논문을 통해서 비임상연구를 통해 임상연구를 예측할 수 있는지에 대한 리뷰 페이퍼가 많이 있습니다. 그중에 한 논문을 정리해서 이야기해보도록 하겠습니다.
1. The role of non-clinical studies
1.1. The role of non-clinical studies
- Clinical trials
- Risk management and mitigation
- New Drug Application (NDA)
- The prescription of a medicine to a patient
- Post-marketing or monitoring studies
1.2. The objective of non-clinical studies
To demonstrate the efficacy and provide knowledge on the safety profile of the candidate compound.
To estimate the effects of the candidate compound that cannot be studied in humans.
• 비임상 데이터는 임상연구를 위한 근거로써 사용될 수 있으며, 임상에서 나타날 수 있는 위험관리에 중요한 역할을 할 수 있습니다. 또한 NDA 자료로써 사용할 수 있고, 환자에게 약물 처방에 근거 자료로 사용될 수 있습니다. 또한 지속적인 약물 효과와 안정성 연구 모니터링하는 수단으로 사용하게 됩니다.
• 비임상연구 목적은 약효를 검증하고 안정성을 확보하는데 있다고 할 수 있습니다. 사람에게서 연구할 수 없는 부분에 대한 데이터를 제공함으로써 임상에서 효과를 예측하는데 중요한 역할을 할 수 있습니다.
2. Extrapolating from animals to humans
- Non-clinical data is most important in early parts of the development process of a candidate compound.
- Most of the non-invasive data on safety and efficiency will be replaced by data obtained from clinical trials in human patients.
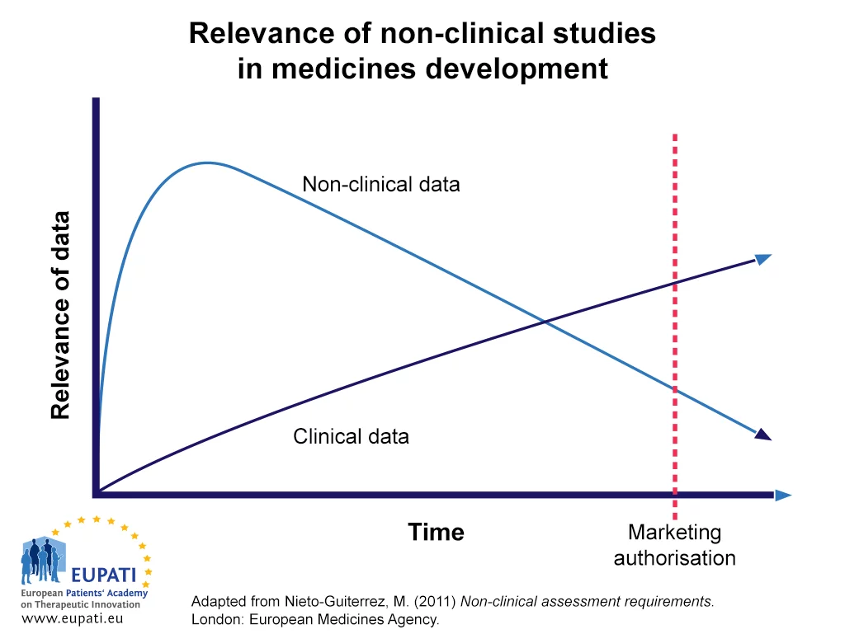
• 약물개발 과정 중 초반에는 비임상연구자료가 중요도가 크지만, 연구가 진행되면서 임상연구 결과가 나오면서 점점 임상시험 데이터가 비임상연구 데이터를 대체합니다. 그리고 이것이 검증되었을 때 신약 허가 심사가 이뤄집니다.
• 비임상연구에서 compound의 효능과 안정성이 충분히 평가되야합니다. 비임상연구는 임상연구를 진행을 위한 기초적인 자료로써 가치뿐아니라 이후 신약개발 허가에서도 중요한 데이터로 사용될 수 있습니다.
3. The limitations of preclinical studies
- A Study on the concordance between preclinical and human data for biopharmaceuticals (mAb) targeted to cell-surface proteins.
-
Data on the 15 approved biopharmaceuticals were included:Data on the 15 approved biopharmaceuticals were included: abatacept; abciximab; alefacept; alemtuzumab; basiliximab; cetuximab; daclizumab; efalizumab; ipilimumab; muromonab; natalizumab; panitumumab; rituximab; tocilizumab; and trastuzumab.
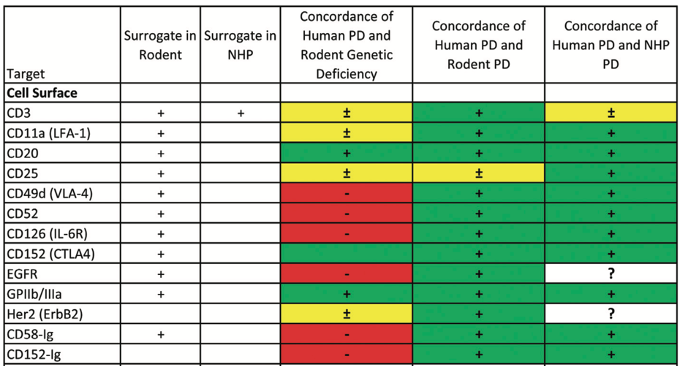
Good concordance with human pharmacodynamics was found for mice receiving surrogates or NHPs receiving the human pharmaceutical.
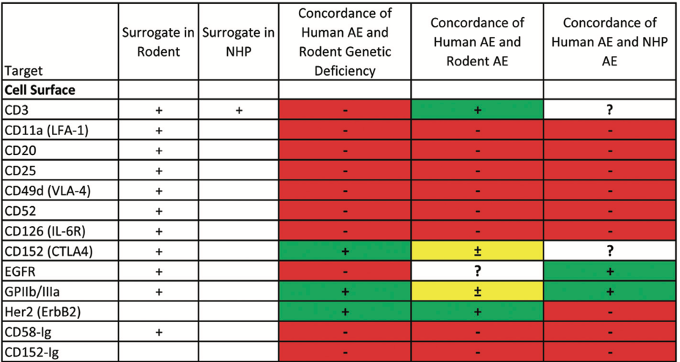
Poor concordance with human AE for mice receiving surrogate molecules or NHPs receiving the cross-reactive human biopharmaceutical
4. The concordance of preclinical data and human data

4.1. The pharmacodynamics of biopharmaceutical in NHPs is largely predictive
•The surrogates in rodents are comparably predictive to the human biopharmaceutical in NHPs
4.2. The toxicology data and clinical safety are less likely to be predicted from preclinical studies
- It’s difficult to predict the repercussions of immune response and control the conditions from human patients in a variety of environmental situations.
- Preclinical toxicology studies are based on hazard identification and subtle effects noted by patients (headache, pain, fatigue, etc.) may not be identified in rodent and NHPs.
- Preclinical AEs that are a direct result of exaggerated pharmacology appear to be largely predictive in human, while other indirect outcomes of immunomodulation are less likely to be predicted.
- The serious toxicity issue in NHP are not likely to advance to clinical trials and therefore remain untested in humans, so the concordance data are skewed to drugs with rare adverse effect.
• 결과적으로 동물을 이용한 efficacy는 동물을 통해서 어느정도 예측이 가능함.
• 약물의 개발이 진행되기 위해서 동물에서 예상되는 biological effect 가 검증되어야기 때문에 이런 약물만 살아남아서 효과적으로 일치되는 결과가 많음.
• 마찬가지로 rodent, NHP까지는 안정성이 검증된 약물만이 사람에서도 실험이 진행되기 때문에 부작용이 많이 나타나며, 사소한 부작용을 동물에서는 평가하기 어렵기 때문에 사람에서는 subtle effect가 많이 나타남.
• NHP의 심각한 독성 문제는 임상시험으로 진전되지 않을 가능성이 높기 때문에 인체에서 검증되지 않은 상태로 남아 있기 때문에 일치성 데이터는 드물게 부작용이 있는 약물에 치우쳐 있습니다.
(Preclinical adverse effects that are a direct result of exaggerated pharmacology appear to be largely predictive in humans, while opportunistic infections or other indirect out- comes of immunomodulation, along with cytokine release- related events, are less likely to be predicted from routine preclinical studies.)