닌텐다닙(nintedanib)은 IPF 치료제로 Pirfenidone과 함께 first-in-class의 길을 걸어 치료제로 허가받은 약물입니다.
IPF 약물이 없는 상황에서 이들이 개발되는 과정 투쟁의 역사라고 할 수 있습니다. 약물들의 MOA를 증명하고, 임상적인 유의성을 보여주기 위한 Surrogate biomarker 검증하고, 장기간 환자들의 survival을 관찰하는 과정을 보면 IPF 약물 개발에 뛰어들기가 망설여집니다.
하지만 국내외로 다양한 약물이 이들의 선구자를 따라 도전하고 있습니다. 이 시간에는 닌테다닙의 개발 과정에 대해 이야기해보고 FDA와 어떤 논의를 했는지 알아보려고 합니다.
1. Nintedanib 소개
- 닌테다닙은 3가지 receptor tyrosine kinase inhibitor를 조절합니다.
- PDGFR (platelet-derived growth factor receptor) a and b
- FGFR 1-3 (fibroblast growth factor receptor 1-3)
- VEGFR 1-3 (vascular endothelial growth factor receptor 1-3
- Fibroblasts의 proliferation, Migration, Transformation을 억제합니다.
- 그 외 tyrosine kinase inhibitor인 Flt-3, Lck, Lyn, Src를 억제합니다.
2. Regulatory History

2016년 8월:
- pre-IND meeting이 2006년에 있었습니다. 그 당시만 해도 FVC(forced vital capacity)가 환자 생존율의 surrogate marker로 받아들여지지 않았습니다. 근거가 없었기 때문입니다. IPF 약물은 궁극적으로 환자의 수명 연장을 목표합니다. 하지만 환자의 생존율 관찰하기에는 너무 임상시험 기간이 길어질 수밖에 없었습니다. 그래서 기업들은 단기간에 약효를 볼 수 있는 마커로 FVC를 사용하려고 했습니다. 그러나 현재도 FVC와 mortality 연관성에 대해서는 명확하지 않습니다. 하지만 이들의 노력들이 받아들여지고 있습니다. 또 하나의 이슈는 nintedanib의 동물실험에서 독성입니다. 그리고 닌테다닙이 oncolgy에서 먼저 연구되었습니다. 규제기관에서는 암 연구 결과로 IPF환자를 대상으로 임상 시험하는 것은 부적절하다고 판단하였습니다. 임상시험에 참가한 IPF 환자가 폐 이식에 부적합하지 않게 만들 수 있다는 우려를 표명했습니다. 그 결과 미국에서는 IND가 받아들여지지 않았습니다. 그래서 베링거임게하임은 다른 국가에서 임상시험을 진행하게 되었습니다.
2010년 12월:
- pre-IND과 이후 End of phase 2 미팅에서도 논의가 되지만 FVC가 survival과 관계가 확립되지 않아 이것을 primary endpoint로 할 것인지 에 대한 논의가 계속되어, BI에서는 임상 2상에서는 서바이벌을 포함한 다양한 endpoint를 탐색적으로 조사하였습니다. 또한 COPD에서 환자에 사용되는 SGRQ 설문지를 사용했습니다. BI에서는 IPF환자에서 SGRQ에 적합한지 서포팅할 근거는 없지만 탐색적으로 평가하였습니다.
2011년 4월:
- 임상 2상을 외국에서 성공적으로 마쳤습니다. 임상 2상에서 나온 임상 결과를 가지고 돌아왔습니다. 이 결과로 2011년 Pre-IND를 다시 open 하였습니다. 그 결과 임상 3상을 미국에서 할 수 있게 허가를 받았습니다.
- 여기서 재미있는 것 중 하나는, non-clinical studies에서 닌테다닙 개발 safety margin에 대한 결과는 없었지만, 임상적인 데이터를 가지고 있었기 때문에 허가를 진행했습니다. 또한 비 임상 연구에서 genotoxicity , carcinogenesis에 대한 연구를 통해 안정성을 확보했습니다. (rat에서 low-dose NOAEL값을 밝혔지만 monkey에서는 실패했음.)
- 이후 임상 3상 두 개를 마치고 FDA와 미팅을 통해, 약물이 주는 베네핏이 리스크보다 크다고 결론을 내리면서 약물 판매 허가를 받았습니다. 대신 moderate-to-severe hepatic impairment 환자를 대상으로 하는 간 독성에 대한 후속적인 연구를 진행하라고 권고하였습니다.
3. Flow of Studies
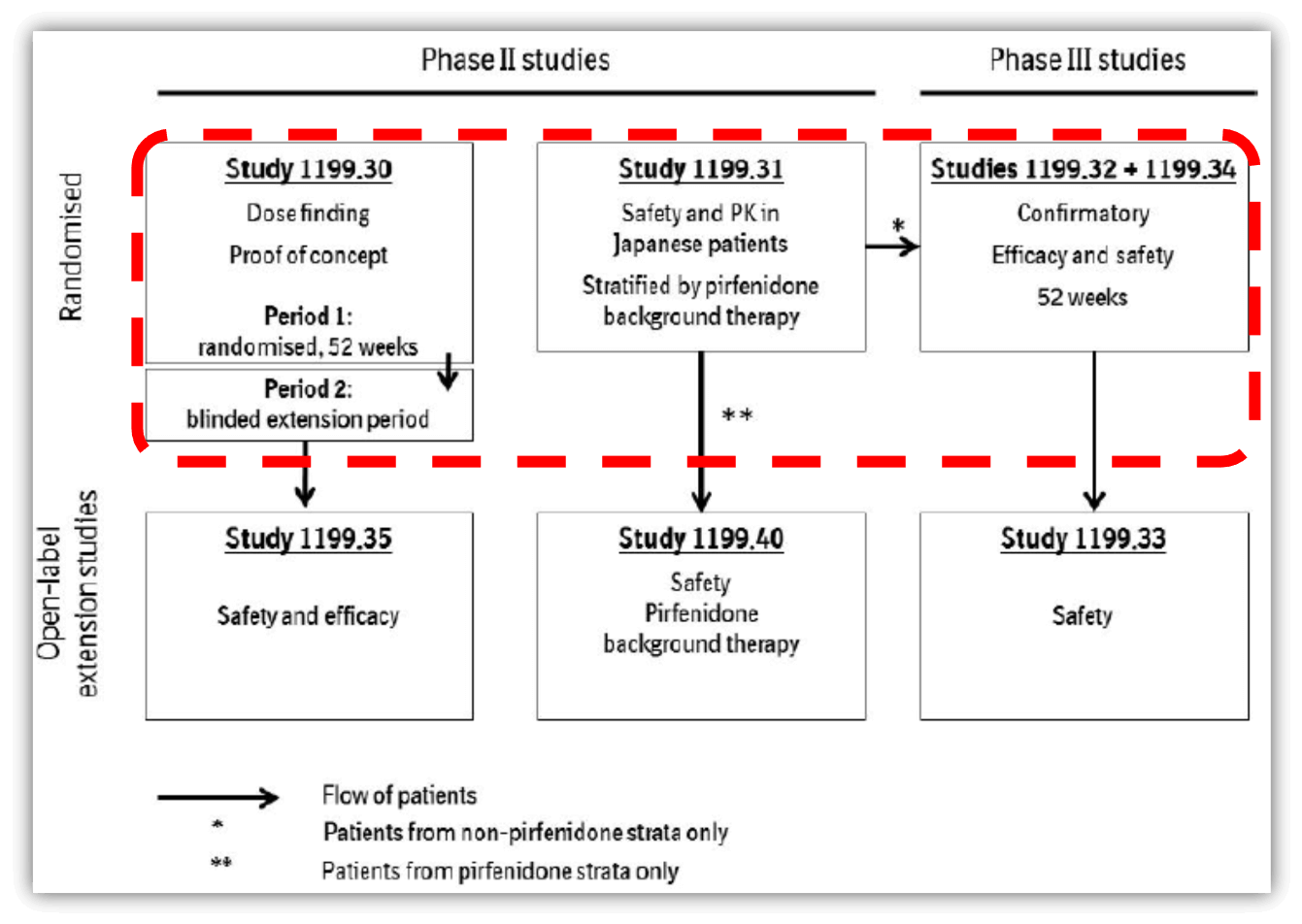
닌테다닙은 Study 30, Study 32, Study 34의 연구 결과를 바탕으로 품목허가를 받았습니다. Study 30는 dose finding 연구였고, Study 30, 32는 임상 3상에서 efficacy와 safety를 52주간 관찰하였습니다.
4. Phase II

5. Phase III

6. Efficacy

- All three studies were randomized, double-blind, placebo-controlled, parallel group in design, conducted in patients with a diagnosis of IPF
- o primary efficacy variable was the annual rate of decline in FVC from baseline to week 52
- o Key 2nd endpoint: time to first IPF exacerbation, SGRQ score from baseline to week 52
- o In Studies 32 and 34, patients could be treated with a reduced dose (100 mg BID) to manage adverse events
7. Primary Efficacy Endpoint
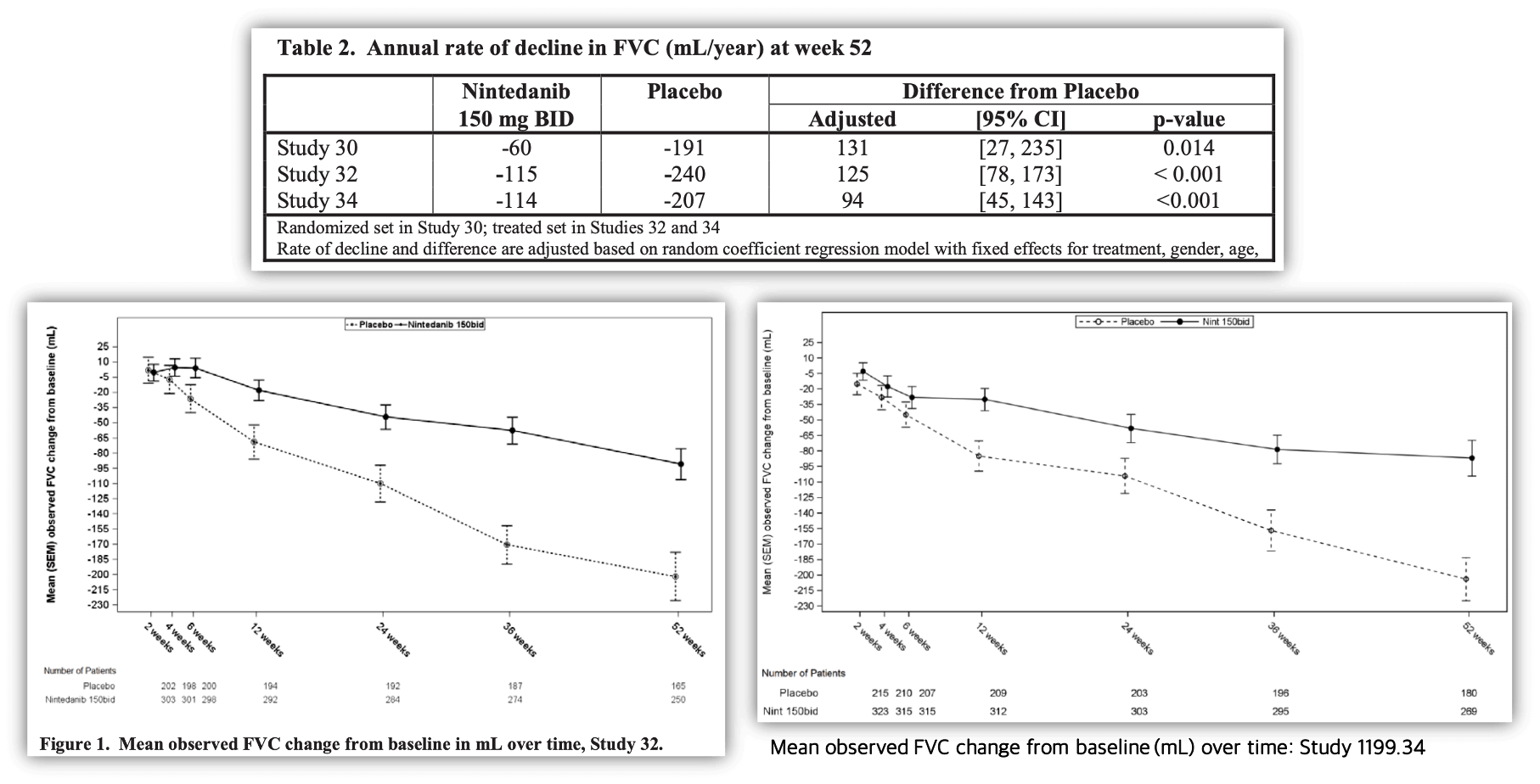
Primary Efficacy Results
The primary endpoint for all 3 studies was the rate of decline in FVC (mL) over 52 weeks. Details for each study are summarized below.
Study 1199.32
The adjusted annual rate of decline in FVC was lower in the nintedanib group (-115 ml/year) than in the placebo group (-240 mL/year). The adjusted difference between nintedanib and placebo was statistically significant: 125 mL/year (95% CI: 78, 173).
Study 1199.34
The adjusted annual rate of decline in FVC was also lower in the nintedanib group (-114 ml/year) than in the placebo group (-207 ml/year). The adjusted difference between nintedanib and placebo was slightly numerically lower than in Study 1199.32, but still statistically significant: 94 mL/year (95% CI: 45, 143).
Study 1199.30
As in the phase 3 studies, the adjusted annual rate of decline in FVC was also lower in the 150 mg BID nintedanib group (-60 ml/year) than in the placebo group (-190 ml/year). The adjusted difference between nintedanib and placebo was slightly higher than the phase 3 studies at 131 mL/year (95% CI: 27, 235). The 150 mg bid dose reached nominal significance (p=0.0136, hierarchical testing procedure specified in the pre-specified statistical analysis plan as a sensitivity analysis,). Protection of alpha (type I error) was not achieved for the multiplicity correction procedure (p= 0.0639).
8. Clinical Pharmacology

'심각한_질병이야기 > Respiratory disorder' 카테고리의 다른 글
| 한미제약 HM15211 [국내 IPF 치료 약물 개발 4] (0) | 2022.09.23 |
|---|---|
| 나이벡 NIPEP-PF(NP-201)[국내 IPF 치료 약물 개발 3] (0) | 2022.09.22 |
| 브릿지바이오 BBT-877 [국내 IPF 치료 약물 개발 2] (0) | 2022.09.21 |
| 대웅제약 DWN1208 [국내 IPF 치료 약물 개발 1] (0) | 2022.09.20 |
| 현재까지 알려진 COPD biomarker 모음 (0) | 2022.09.15 |